Kepolaran Suatu Senyawa Kovalen Tergantung Dari A Jumlah Elektron Pada Atom Pusat

Jika dua atom nonlogam sejenis diatomik membentuk suatu senyawa kovalen misalkan h 2 n 2 br 2 dan i 2 maka ikatan kovalen yang terbentuk memiliki keelektronegatifan yang sama atau tidak memiliki perbedaan keelektronegatifan.
Kepolaran suatu senyawa kovalen tergantung dari a jumlah elektron pada atom pusat. Polar atau nonpolar suatu molekul tergantung dari. Simetris atau tidak posisi antar atom. Jumlah tarikan atom yang diberikan pada elektron disebut elektronegativitas atom dengan elektronegativitas tinggi seperti fluor oksigen dan nitrogen mengerahkan daya tarik elektron lebih besar daripada atom dengan elektronegativitas rendah. Dalam hal ini jumlah elektron yang dipasangkan harus disamakan.
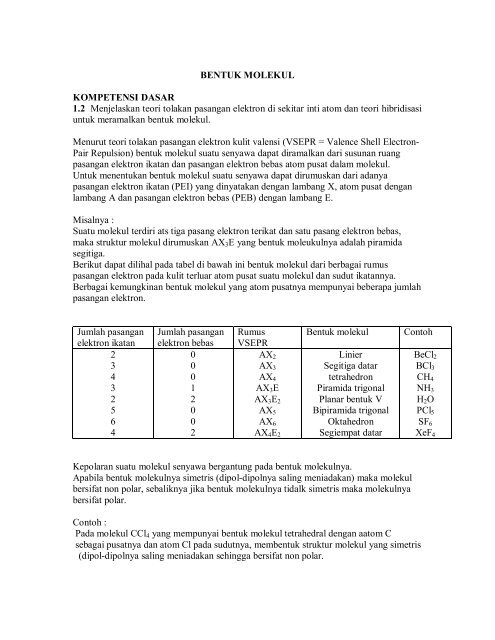
Potensial antara dua atom e. X atau pei 3 lihat saja jumlah subtituen yang terikat pada atom pusat karena pada molekul terikat 3 buah atom f pada atom pusat cl maka jumlah pei nya adalah 3 jumlah elektron ikatan 3 karena jenis ikatan kovalen yang terjadi antara f dan cl adalah tunggal sehingga dibutuhkan 3 buah elektron cl untuk berikatan dengan 3 buah atom f. Potensial ionisasi di antara dua atom penyusun senyawa soal 25 bentuk geometri molekul dari sf6 adalah. Bentuk molekul dari ccl4 adalah simetris tidak ada pasangan elektron bebas pada struktur molekul lewisnya dan tidak terjadi pengutuban atom atau polarisasi muatan karena pasangan elektron dalam ikatan digunakan secara seimbang di antara atom pusat c dan 4.
Akan tetapi perlu diingat bahwa aturan oktet tidak selalui dipatuhi terdapat beberapa senyawa kovalen yang melanggar aturan oktet. Atom hidrogen memiliki elektron valensi 1 sedangkan atom oksigen memiliki elektron valensi 6. Selisih momen dipol di antara atom penyusun senyawa c. Sehingga senyawa ini digolongkan pada senyawa polar.
Pada molekul ccl4 terdapat 4 ikatan kovalen polar antara atom pusat c dan 4 atom cl. Rumus kimia senyawa kovalen. Kepolaran molekul 1 1 molekul nonpolar dan molekul polar suatu molekul dapat bersifat polar maupun nonpolar. Tidak semua atom menarik elektron dengan kekuatan yang sama.
Penjelasan mengenai gaya tarik menarik ini sangatlah rumit dan dijelaskan oleh elektrodinamika kuantum. Kepolaran suatu senyawa kovalen tergantung dari. Ikatan kimia adalah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Maka pada senyawa ini akan terbentuk 2 ikatan kovalen tunggal dan memiliki pasangan elektron bebas.
Tersusun atas atom atom yang berbeda dengan ikatan ikatan yang ada merupakan ikatan kovalen polar namun karena. Jumlah elektron pada atom pusat. Suatu molekul bersifat nonpolar apabila. Senyawa air memiliki rumus kimia h2o artinya terdiri dari 2 atom hidrogen dan 1 atom oksigen.
Jumlah elektron pada atom pusat b. Ikatan kovalen tersebut dinamakan ikatan kovalen nonpolar dalam pembentukan molekul i 2 kedua elektron dalam ikatan kovalen digunakan secara seimbang oleh kedua. Gaya tarik antara atomnya d. Kepolaran suatu senyawa kovalen tergantung dari.
Selisih momen dipol diantara atom atom penyusun senyawa. Dalam sebuah ikatan ini menyebabkan pembagian elektron yang. Tersusun atas atom atom yang sama seperti p4 s8 dan c60 fulerena dengan ikatan ikatan yang ada merupakan ikatan kovalen nonpolar.