Senyawa Yang Memiliki Ikatan Kovalen

Senyawa ionik biasanya terbentuk antara atom atom unsur logam dan nonlogam.
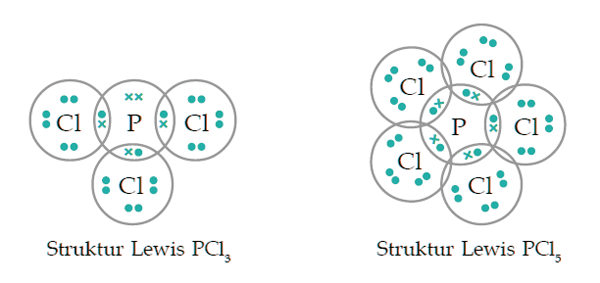
Senyawa yang memiliki ikatan kovalen. Pasangan senyawa berikut ini yang merupakan pasangan senyawa yang memiliki suatu ikatan kovalen ialah. Sementara penamaan senyawa ion nama logam selalu datang pertama. Titik didih dan titik leleh rendah disebabkan gaya tarik menarik antar molekulnya sangat lemah. Bagi sebagaian siswa membedakan manakah yang termasuk golongan senyawa ion dan mana yang masuk golongan senyawa kovalen bukan perkara mudah.
Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa distribusi elektronnya dan ukuran kuantitatif titik didih. Ikatan kovalen dan ikatan ion masing masing memiliki sifat yang berbeda dimana hal ini turut dipengeruhi oleh senyawa senyawa penyusunnya. Ikatan kovalen umumnya terjadi antara atom atom unsur nonlogam bisa sejenis contoh. Senyawa yang hanya mengandung ikatan kovalen disebut senyawa kovalen.
Ikatan kovalen koordinasi adalah ikatan yang terbentuk dari pemakaian pasangan elektron bersama yang berasal dari salah satu atom yang memiliki pasangan elektron bebas. Unsur a yang bernomor atom 38 bersenyawa dengan unsur b yang bernomor atom 53. Senyawa kovalen adalah senyawa yang terbentuk dari sesama unsur unsur nonlogam dengan cara membentuk ikatan kovalen penggunaan pasangan elektron bersama. Senyawa kovalen mengandung dua atau lebih unsur non logam yang diikat bersama oleh ikatan kovalen di mana atom yang berpasang berbagi elektron valensi.
H2o co2 dan lain lain. Senyawa yang memiliki ikatan ion disebut senyawa ionik. H2 s dan na2 s. Molekul adalah partikel terkecil dari suatu senyawa kovalen yang masih memiliki sifat sifat senyawa.
Senyawa polar dan non polar pengertian ciri kovalen perbedaan sifat titik didih contoh. Pada senyawa ikatan kovalen seperti h 2 o 2 n 2 cl 2 hcl dan co 2 memiliki wujud gas dalam suhu ruangan. H2 n2 o2 cl2 f2 br2 i2 dan berbeda jenis contoh. H2 n2 o2 cl2 f2 br2 i2 dan berbeda jenis contoh.
Oleh sebab itu tidak seperti ikatan kovalen yang hanya bisa terbentuk antara non logam ikatan ion bisa terbentuk antara logam dan non logam. Senyawa dan ikatan yang terbentuk ialah. Berbeda dengan sifat senyawa ion yang memiliki titik didih dan itik lebur yang tinggi senyawa kovalen justru memiliki titik didih maupun titik lebur yang rendah. H2o co2 dan lain lain.
Senyawa dengan ikatan kovalen umumnya memiliki titik leleh dan titik didih yang rendah.